Diferencias estructurales
Las diferencias estructurales que existen entre los diferentes tipos de hidrocarburos se basan principalmente en el tipo de enlaces entre los átomos de carbono y en la disposición geométrica de los mismos.
De esta manera, se pueden distinguir varias clases de hidrocarburos, cada una con características específicas.
Alcanos
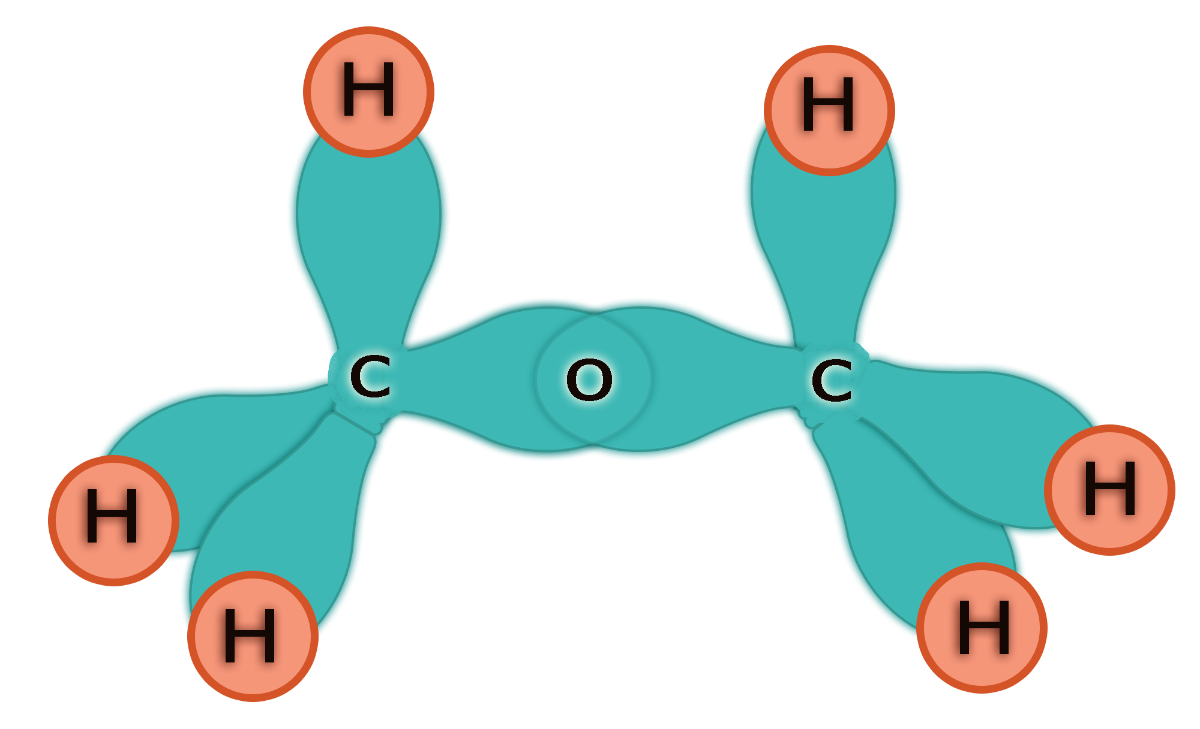
Son hidrocarburos saturados, por lo tanto, sólo se conforman por enlaces simples (C–C) entre átomos de carbono.
En este caso, la geometría alrededor de cada átomo de carbono es tetraédrica, lo que le confiere una conformación tridimensional flexible.
Además, la hibridación de los átomos de carbono en los alcanos es del tipo sp3, lo que significa que cada átomo de carbono mezcla un orbital s con tres orbitales p, formando de esta manera cuatro orbitales híbridos equivalentes que se disponen hacia los vértices de un tetraedro.
El ángulo de enlace es de aproximadamente 109,5°.
Alquenos:
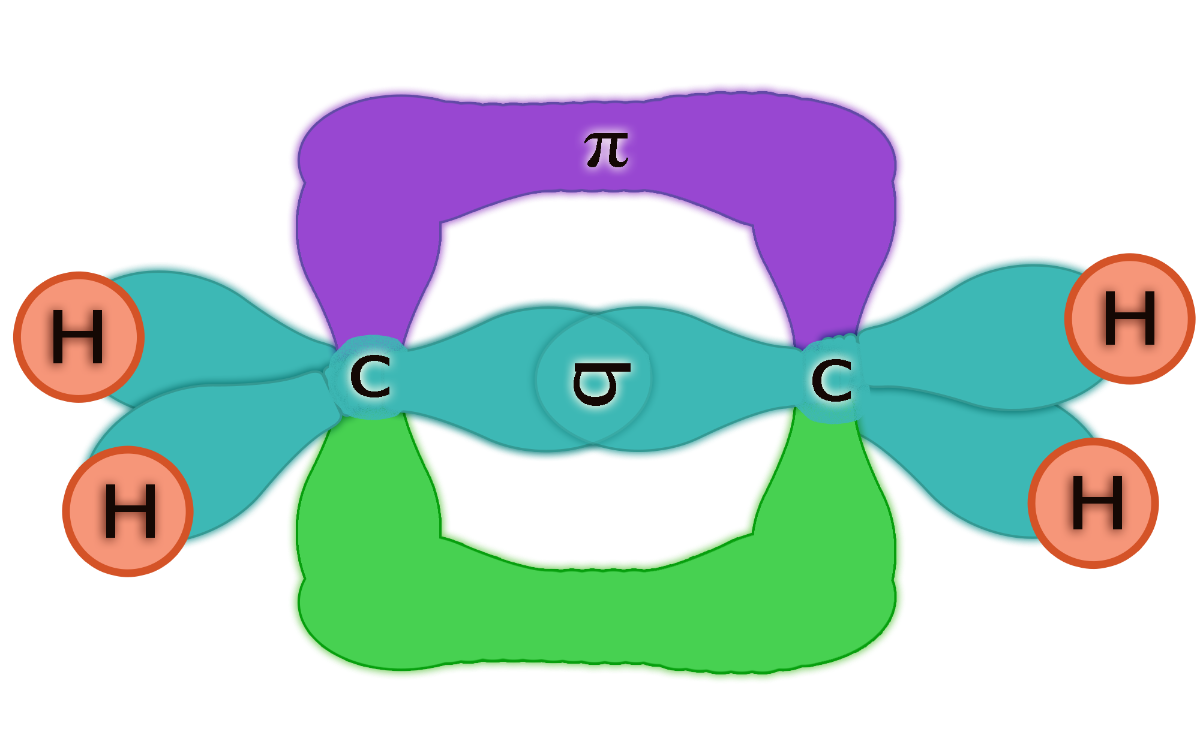
Los alquenos son hidrocarburos insaturados que contienen al menos un doble enlace (C=C) entre dos átomos de carbono.
Como resultado, la geometría alrededor de los carbonos involucrados es trigonal plana, lo que restringe la rotación en torno al enlace y puede dar ligar a isómeros geométricos (cis/trans).
En este caso, los carbonos tienen hibridación del tipo sp2, donde un orbital s se combina con dos orbitales p, formando tres orbitales híbridos dispuestos en un plano con ángulos de 120°.
El tercer orbital p restante es el que forma el enlace π del doble enlace.
Alquinos:
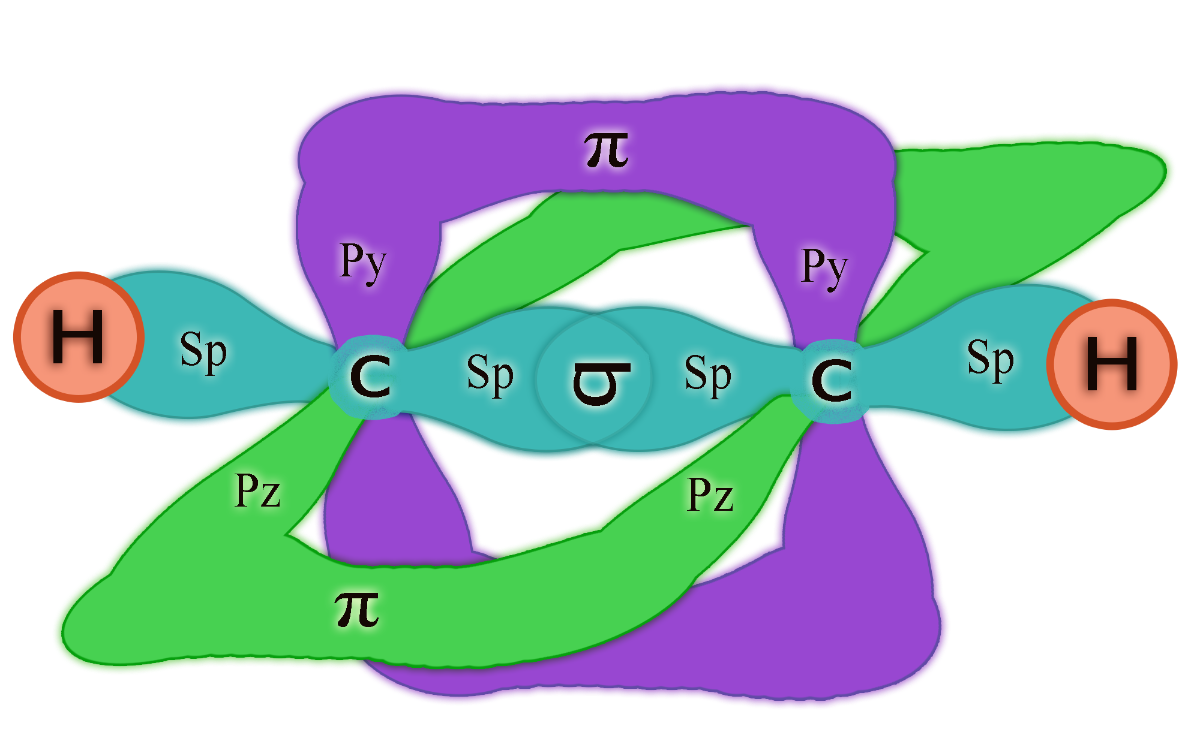
De manera similar, los alquinos son compuestos son insaturados, debido a que contienen al menos un triple enlace (C≡C) entre dos átomos de carbono.
Debido a esta estructura, los carbonos que participan del triple enlace se encuentran unidos a dos átomos, lo que les confiere una geometría lineal (ángulos de 180°) y una estructura más rígida.
Aquí, los carbonos que están involucrados en el doble enlace tienen hibridación sp.
En esta hibridación, un orbital s se combina con un orbital p, formando dos orbitales híbridos lineales.
Los dos orbitales p restantes forman los dos enlaces π del triple enlace.
Cicloalcanos:
En el caso de los cicloalcanos contienen enlaces simples (C–C) en una estructura cíclica, esto les otorga una geometría similar a la de los alcanos, pero con restricciones debido al ciclo.
Los átomos de carbono suelen presentar hibridación sp3, igual que los alcanos lineales.
Sin embargo, en ciclos más pequeños, como el ciclopropano, los ángulos de enlace pueden estar forzados y ser más pequeños que los 109,5° habituales.
Cicloalquenos:
Finalmente, los cicloalquenos contienen un doble enlace (C=C) dentro de un anillo, lo que le confiere una geometría del tipo trigonal plana alrededor de los carbonos que participan del doble enlace.
Al igual que los alquenos, los carbonos involucrados en el doble enlace presentan hibridación sp2, igual que en los alquenos.
Los demás carbonos del ciclo, si están saturados, tienen hibridación sp3.
Los ángulos de enlaces en los carbonos con hibridación sp2 son de aproximadamente 120°.